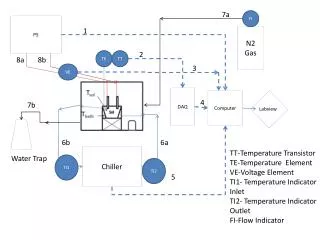
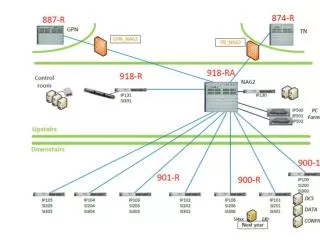
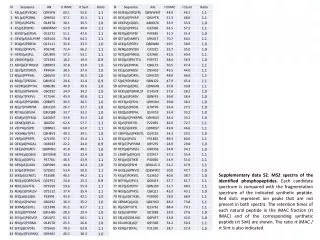
PS 1
240 likes | 478 Vues
PS 1. Prof. Bivis. Tabela periódica. GRUPO DO BORO. CALCOGÊNIOS. HALOGÊNIOS. GRUPO DO CARBONO. GRUPO DO NITROGÊNIO. GASES NOBRES. Metais Alcalinos. Alcalinos - TERROSOS. ELEMENTOS REPRESENTATIVOS. Famílias ou grupos. 18. 1. 2. 13 14 15 16 17.

PS 1
E N D
Presentation Transcript
GRUPO DO BORO CALCOGÊNIOS HALOGÊNIOS GRUPO DO CARBONO GRUPO DO NITROGÊNIO GASES NOBRES Metais Alcalinos Alcalinos - TERROSOS ELEMENTOS REPRESENTATIVOS Famílias ou grupos 18 1 2 13 14 15 16 17 3 4 5 6 7 8 9 10 11 12 ELEMENTOS DE TRANSIÇÃO
Propriedades periódicas Eletronegatividade Eletropositividade Potencial de ionização Raio atômico Eletroafinidade Densidade
Eletronegatividade É a capacidade que um átomo tem de atrair elétrons (ametais). Varia da esquerda para a direita e de baixo para cima, excluindo-se os gases nobres. H B C N OF Cl Br I Fr
Eletropositividade ou Caráter Metálico: É a capacidade que um átomo tem de perder elétrons (metais). Varia da direita para a esquerda e de cima para baixo excluindo-se os gases nobres. H F Li Na K Rb Cs Fr
Potencial de Ionização É a energia necessária para arrancar um elétron de um átomo, no estado gasoso, transformando-o em um íon gasoso. Varia como a eletronegatividade e inclui os gases nobres. A segunda ionização requer maior energia que a primeira e, assim, sucessivamente. H He Ne Ar Kr Xe Rn Fr
Raio Atômico É a distância que vai do núcleo do átomo até o seu elétron mais externo. Inclui os gases nobres. H He Li Na K Rb Cs Fr
Eletroafinidade É a energia liberada quando um átomo recebe um elétron (Afinidade Eletrônica). Varia como o Potencial de Ionização. Não inclui os Gases Nobres. H Fr
Densidade É a razão entre a massa e o volume do elemento. Varia das extremidades para o centro e de cima para baixo. Os Ir
Resumo das propriedades Eletronegatividade; Potencial de ionização; Eletroafinidade. Eletropositividade; Raio atômico
NÚMERO DE MASSA ( A ) É a soma do número de prótons (Z ou P) e o número de nêutrons (N) do átomo PARTÍCULAS MASSA RELATIVA 1 PRÓTONS 1 NÊUTRONS ELÉTRONS 1/1836 Próton Nêutron Elétron A = Z + N P = 4 e N = 5 4 A = Z + N 5 A = 9
ÍONS + – Próton Nêutron Elétron 0 – – 2+ 8 ÍON É a espécie química que tem o número de prótons diferente do número de elétrons – – íon cátion Be – – – 4 + + + + + + – + + + + + + – – 2– 16 – íon ânion O 8 –
Quando o átomo PERDE elétrons o íon terá CARGA POSITIVA e será chamado de CÁTION O átomo de ferro PERDEU 3 ELÉTRONS para produzi-lo 3+ 56 Fe 26
Quando o átomo GANHA elétrons o íon terá CARGA NEGATIVA e será chamado de ÂNION O átomo de oxigênio GANHOU 2 ELÉTRONS para produzi-lo 2 – 16 O 8