Reaktsiooni kiirus
100 likes | 517 Vues
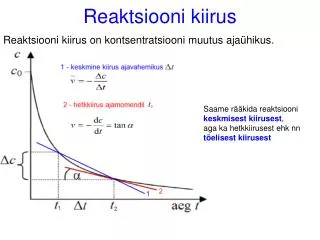
Reaktsiooni kiirus on kontsentratsiooni muutus ajaühikus. Reaktsiooni kiirus. Saame rääkida reaktsiooni keskmisest kiirusest , aga ka hetkkiirusest ehk nn tõelisest kiirusest. Reaktsiooni üldine kiirus :.

Reaktsiooni kiirus
E N D
Presentation Transcript
Reaktsiooni kiirus on kontsentratsiooni muutus ajaühikus. Reaktsiooni kiirus Saame rääkida reaktsiooni keskmisest kiirusest, aga ka hetkkiirusest ehk nn tõelisest kiirusest
Reaktsiooni üldine kiirus: uJ on stöhhiomeetriline koefitsient, mis on lähteainel negatiivne ja produktil positiivne. Reaktsioonis osalevate ainete tekkimise ja tarbimise kiirus Tavaliselt osaleb reaktsioonis rohkem aineid. Reaktsiooni A + 2B 3C + D kohta võib kirjutada: B tarbimise kiirus = 2 x A tarbimise kiirus D tekkimise kiirus = 3 x C tekkimise kiirus
Reaktsiooni kineetiline võrrand Reaktsiooni kineetiline võrrand ehk kiiruse võrrand näitab, kuidas reaktsiooni kiirus sõltub lähteainete kontsentratsioonidest. Reaktsioone, mille kineetiline võrrand vastab reaktsioonivõrrandile, nimetatakse lihtsateks reaktsioonideks: A B kiirusv = kcA A + B C kiirusv = kcAcB Näiteks Keerukamate reaktsioonide kineetilist võrrandit ei saa reaktsiooni-võrrandi põhjal koostada, see tuleb määrata eksperimentaalselt. teist järku reaktsioon esimest järku reaktsioon
Reaktsiooni järk Reaktsiooni järk on kineetilise võrrandi kontsentratsioonide astmenäitajate summa Oletame, et reaktsiooni A + 2B C + Dkineetiline võrrand on v = kcAcB2 See reaktsioon on järelikult kolmandat järku. Reaktsiooni üldine järk on 3, järk A suhtes on 1 ja järk B suhtes on 2. Reaktsiooni kiirus ei sõltu aga üldse ammoniaagi kontsentratsioonist. See on nullindat järku reaktsioon: v = k
Miks on vaja teada reaktsiooni kineetilist võrrandit? • Nende põhjal on võimalik saada informatsiooni reaktsiooni mehhanismi kohta: • millised võiksid olla reaktsiooni staadiumid • milline staadium on arvatavasti kiire ja milline aeglane • milline staadium määrab oletatavalt kogu reaktsiooni kiiruse (kõige aeglasem) • millised osakesed osalevad reaktsiooni elementaarakti(de)sMolekulaarsus – reaktsiooni elementaaraktist osavõtvate lähteainete osakeste arv On olemas mono-, bi- ja tri-molekulaarsed reaktsioonid, viimased neist väga haruldased, sest kolme osakese korraga põrkumine on vähetõenäoline
Reaktsioon on sellise järguga, mille graafik tuleb sirge. Poolestusaja* meetod *Poolestusaeg on aeg, mille jooksul reageerib ära pool lähteainest. Võib määrata erinevate kineetiliste võrrandite alusel kiiruskonstandid erinevatel ajamomentidel ja vaadata, millise valemi järgi kiiruskonstandi väärtus ei muutu. Kineetilise võrrandi määramine 2
Reaktsiooni kiiruse sõltuvus temperatuurist Reaktsiooni kiiruse temperatuurist sõltuvust kirjeldab empiiriline Arrheniuse võrrand: kus E on reaktsiooni aktivatsioonienergia ja Aeksponendieelne kordaja (A ja E võib lugeda konstandiks, kui temperatuurimuutus ei ole suur). Arrheniuse võrrandi logaritmimisel saame sirge võrrandi, mille tõusust saab määrata aktivatsioonienergia: