Isomeria
180 likes | 258 Vues
Mais uma aula da DodoExpress, hoje falamos de Isomeria, o que u00e9, e como funciona.<br>Espero que gostem e que ajudem a estudar, quem puder compartilhe com conhecidos para ajudar o nosso trabalho, e fiquem ligados nas pru00f3ximas aulas!!

Isomeria
E N D
Presentation Transcript
http://www.ufjf.br/quimica/files/2015/11/Familia-dos-Gases-Nobres.ppthttp://www.ufjf.br/quimica/files/2015/11/Familia-dos-Gases-Nobres.ppt
O que é isomeria? A isomeria é um fenômeno em que compostos orgânicos possuem mesma fórmula molecular, mas apresentam estrutura molecular e propriedades diferentes, os elementos que adquirem isomeria são denominação de isômeros. Isso é uma consequência do fato do carbono ser tetravalente, de tal modo que ao mudar uma de suas ligações cria-se uma nova molécula, que todavia terá a mesma quantidade de carbonos e hidrogênios. No grego a palavra “isômero” significa partes iguais, pois “iso” é “igual” e “meros” é “parte”.
Isomeria Plana A isomeria plana divide-se em cinco diferentes categorias. A de Posição, a diferença se encontra na localização da ramificação e da ligação dupla ou tripla. OU C5H10 C8H10
A de Cadeia, a diferença está na classificação da cadeia quanto a ela ser aberta ou fechada, ramificada ou normal. Butano Metilpropano C4H10 C3H6
A de Função, os compostos se diferenciam por pertencer a grupos funcionais diferentes. C2H6O
A de Metameria, a diferença está na localização do heteroátomo. C4H10O C4H4O2
A de Tautomeria, a diferença está entre a localização da ligação π e o hidrogênio ligado, isso ocorre entre um enol e uma cetona ou um enol e um aldeído, onde no enol há uma hidroxila ligada à um carbono sp2, enquanto na cetona ou no aldeído a ligação dupla vai para o oxigênio e o carbono e o hidrogênio da hidroxila vai para o carbono que perdeu a ligação dupla em relação ao enol. C2H4O C3H6O
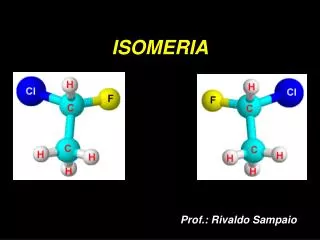
Isomeria Óptica São compostos que se ativam através da luz. Ela acontece quando uma substância é provocada pelo desvio angular no plano de luz polarizada. • Quando uma substância desvia a luz óptica para a direita é denominada dextrogira. • Quando uma substância desvia a luz óptica para a esquerda, a substância é denominada levógira. Enantiômero é o par formado pelo levógiro e dextrógiro. Os enantiômeros apresentam uma estrutura que se assemelha a uma imagem refletida num espelho, as quais não são sobreponíveis e, sim, especulares.
Como saber se um composto tem isomeria óptica? É verificado mediante o uso de um polarizador, um carbono quiralé quandoo composto contém pelo menos um carbono assimétrico (C*). O carbono assimétrico possui 4 ligantes diferentes, tal como mostra a imagem abaixo.
Isomeria Geométrica Ocorre em moléculas onde dois dos carbonos de uma cadeia mista, aberta ou fechada não apresentam rotação em seus eixos. As ligações sempre ocupam planos fixos em diferentes planos ou no mesmo plano.
Essa isomeria é diferenciada por meio de dois sistemas de nomenclatura: Isomeria geométrica cis-trans: • Cadeias abertas: Ligação dupla entre dois carbonos, que possuem o mesmo número de ligantes entre si. “https://alunosonline.uol.com.br/quimica/isomeria-geometrica-ou-cistrans.html”
Cadeias Fechadas: Possuem dois carbonos com o mesmo número de ligantes entre si.
Isomeria geométrica E-Z: Esse tipo de isomeria ocorre quando dois carbonos com ligação dupla entre eles possui ligantes distintos em todas as outras ligações disponíveis. A partir disso vem as classificações E e Z, para verificá-las é preciso primeiro ver separadamente em cada carbono qual é o seu ligante com maior número atômico. Com isso deve-se ver se estes ligantes estão na mesma linha ou plano, sendo assim caracterizada como Z, Z = juntos, mas se eles estiverem em extremos opostos, então será classificado como do tipo E, E = opostos. Z E
Cadeias abertas: Ligação dupla entre dois carbonos, que possuem diferentes números de ligantes entre si. Fórmula estrutural do 3-metilpent-2-eno • Cadeias fechadas: Ligação simples entre carbonos. Dois carbonos da cadeia possuem diferentes números de ligantes entre si. 1- bromo-1-etil-2-metil-ciclopentano
Referências Bibliográficas FOGAÇA , Jennifer. Tipos de isomeria. [S. l.], [201?]. Disponível em: https://m.brasilescola.uol.com.br/quimica/tipos-isomeria.htm. Acesso em: 26 jun. 2019. MAGALHAES, Lana. Hidrocarbonetos. [S. l.], [201?]. Disponível em: https://www.todamateria.com.br/hidrocarbonetos/. Acesso em: 26 jun. 2019. DIAS, Diogo. Isomeria. [S. l.], [201?]. Disponível em: https://m.mundoeducacao.bol.uol.com.br/quimica/isomeria.htm. Acesso em: 26 jun. 2019.