GLI ELEMENTI
130 likes | 374 Vues
GLI ELEMENTI. Sono attualmente 118. 96 naturali. 22 artificiali. Sono tutti contenuti nella Tavola periodica degli elementi. La tavola periodica. Mendeleev inventa un modo per raggruppare gli elementi. 1869. Un numero che ci dice quanti elettroni o protoni ha ogni suo atomo.

GLI ELEMENTI
E N D
Presentation Transcript
GLI ELEMENTI Sono attualmente 118 96 naturali 22 artificiali Sono tutti contenuti nella Tavola periodica degli elementi
La tavola periodica Mendeleev inventa un modo per raggruppare gli elementi 1869
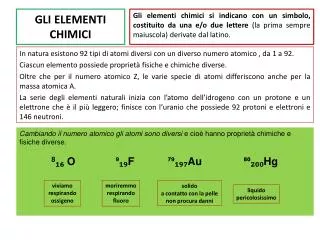
Un numero che ci dice quanti elettroni o protoni ha ogni suo atomo Ogni elemento è caratterizzato da: Un numero che ci dice la massa di ogni suo atomo Un simbolo costituito da una lettera maiuscola o due lettere: una maiuscola e una minuscola
GLI ATOMI Dal greco ἄτομος - àtomos -, indivisibile Considerato l'unità più piccola ed indivisibile della materia (concetto risalente alla dottrina del filosofo greco Democrito). Gli atomi costituiscono tutta la materia.
Ogni atomo contiene: Un NUCLEO fatto da PROTONI (particelle cariche positivamente) e NEUTRONI (particelle neutre) Degli ELETTRONI che orbitano attorno al nucleo descrivendo delle ellissi. Il numero di neutroni è uguale a quello degli elettroni (uguale al numerino scritto nella tavola periodica) perciò l’atomo è totalmente neutro.
Quindi gli atomi di ogni elemento sono diversi tra loro per GRANDEZZA MASSA COMPOSIZIONE INTERNA
I COMPOSTI Sono formati da più elementi. Sono circa 8 milioni.
Ogni composto ha la sua composizione Ogni composto ha una composizione ben definita sia nel tipo di elementi che lo formano sia nella loro quantità percentuale. Esempio: L’acqua è sempre formata da idrogeno (11%) e ossigeno (89%)
Le molecole Ogni elemento è formato da milioni di atomi tutti uguali. Ogni composto è formato da milioni di molecole tutte uguali. Una molecola è un gruppo di atomi legati tra di loro.
Formula delle molecole Ogni composto è caratterizzato da una formula molecolare che mostra, con simboli e numeri, il tipo e il numero di atomi che compongono la materia. Esempio: = formula acqua = significa che ogni sua molecola è composta da 2 atomi di idrogeno e 1 atomo di ossigeno legati tra loro Esempio: = formula metano = significa che ogni sua molecola è composta da e 1 atomo di carbonio e 4 atomi di idrogeno legati tra loro
Legami chimici Cosa tiene legati tra di loro questi atomi per formare una molecola? C’è una forza che unisce questi atomi detta: legame chimico Si forma perché … Gli atomi di quell’elemento diventano carichi e si attraggono tra loro (legame ionico) Gli atomi condividono degli elettroni tra loro e così si avvicinano (legame covalente) http://www.ovo.com/legami-chimici
Nome dei composti A ciascuna formula è assegnato un nome, che diviene il nome del composto. A volte il nome non c’entra con la formula, come ad esempio l’acqua: In realtà esistono delle REGOLE per assegnare il nome ai composti. Vediamo quelle relative ai composti formati da due elementi …
REGOLE PER I COMPOSTI CON DUE ELEMENTI SE IL COMPOSTO CONTIENE OSSIGENO SE CONTIENE 1 SOLO ATOMO DI OSSIGENO viene detto OSSIDO di.. seguito dal nome dell’altro elemento SE IL COMPOSTO NON CONTIENE OSSIGENO Si aggiunge la desinenza -URO all’elemento più a destra seguito dalla preposizione di e il nome dell’altro elemento SE CONTIENE 2 ATOMI DI OSSIGENO viene detto DIOSSIDO di.. seguito dal nome dell’altro elemento ESEMPIO NaCl = cloruro di sodio E così via … (triossido …) Spesso detta ANIDRIDE CARBONICA ESEMPIO NO= CO2= ossido di azoto Sono molte infatti le eccezioni che non seguono le regole diossido di carbonio